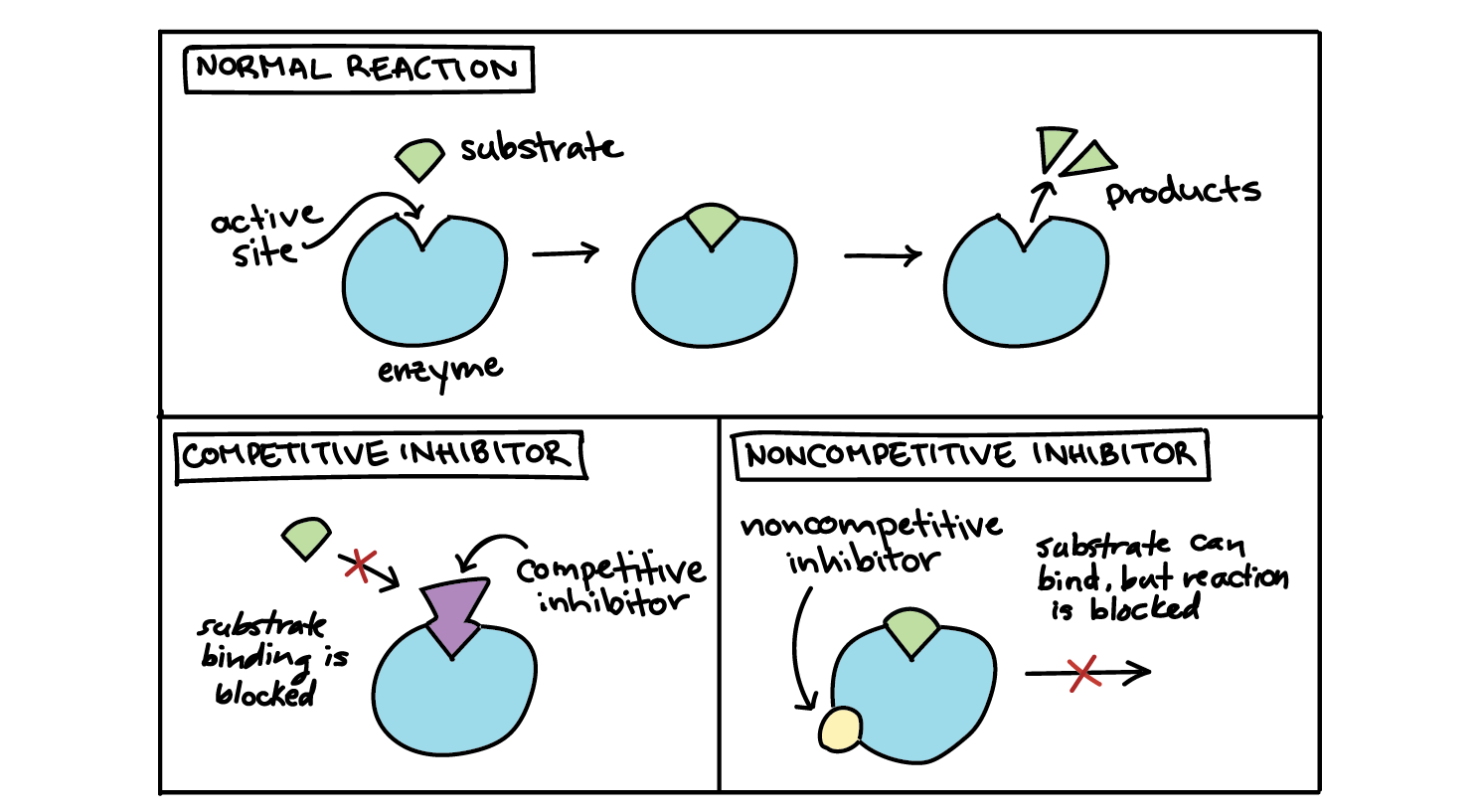
Die kompetitive Hemmung ist eine Art der Enzymhemmung . Hier bindet ein Inhibitor (Hemmstoff) an das aktive Zentrum eines Enzyms . Auf diese Weise wird das Enzym gehemmt, weil das Substrat dann nicht mehr an das aktive Zentrum binden kann.Kompetitive und nicht-kompetitive Hemmung
Bindungsstelle des Inhibitors: Bei der kompetitiven Hemmung bindet der Inhibitor an das aktive Zentrum des Enzyms, bei der nicht-kompetitiven Hemmung bindet der Inhibitor hingegen an das allosterische Zentrum des Enzyms.Als allosterische Hemmung bezeichnet man eine Enzymhemmung, bei welcher die Bindung des Inhibitors nicht am aktiven Zentrum, sondern am allosterischen Zentrum erfolgt. Dabei wird die Konformation des Enzyms so moduliert, dass das Substrat nur erschwert oder gar nicht an das aktive Zentrum binden kann.
Welche Arten von Hemmungen gibt es : Inhaltsverzeichnis
2.1 Kompetitive Hemmung.
2.2 Nichtkompetitive Hemmung.
2.3 Allosterische Hemmung.
2.4 Unkompetitive Hemmung.
2.5 Feedback-Inhibition.
2.6 Irreversible Hemmung.
Was passiert bei der nicht kompetitiven Hemmung
Wenn der Inhibitor am Enzym angedockt ist, verändert sich die Form des aktiven Zentrums. Das führt dazu, dass das Substrat nur noch erschwert oder gar nicht mehr an das Enzym binden kann. Der Inhibitor kann sich wieder vom Enzym lösen. Deshalb ist die nicht kompetitive Hemmung reversibel.
Ist eine kompetitive Hemmung immer reversibel : Kompetitive Hemmung
Der Inhibitor bindet am aktiven Zentrum und blockiert so die Interaktion des Substrats mit der Bindungsstelle. Der Inhibitor kann durch einen Überschuss des Substrats verdrängt werden; daher ist diese Hemmung reversible.
Als kompetitive Hemmung (lat. competere, zusammen etwas begehren) wird in der Biochemie und Pharmakologie eine Enzymhemmung bezeichnet, bei der ein Agonist und ein Antagonist um die Besetzung eines Rezeptors konkurrieren, wobei der Antagonist keine biochemische Wirkung hat. Endprodukthemmung, ein wichtiger Mechanismus zur schnellen Regulation des Stoffwechsels durch reversible Enzymhemmung. Ein am Ende einer Stoffwechselsequenz gebildetes Produkt wirkt als negativer Effektor (Inhibitor) auf ein am Anfang der Reaktionsfolge lokalisiertes, meist allosterisches Enzym.
Ist allosterische Hemmung und nicht kompetitive Hemmung das gleiche
Ist eine allosterische Hemmung reversibel Die allosterische Hemmung ist reversibel und damit umkehrbar. Sie ist auch eine Sonderform der nicht kompetitiven Hemmung, da der Inhibitor nicht mit dem Substrat in Konkurrenz steht.Die allosterische Hemmung ist einer nicht kompetitiven Hemmung, weil der Inhibitor nicht mit dem Substrat um eine Bindestelle konkurriert. Beide binden an verschiedenen Zentren. Außerdem ist die allosterische Hemmung reversibel, also wieder umkehrbar.Nicht-kompetitive Hemmung
Das Substrat kann somit weiterhin an das aktive Zentrum binden, wird aber durch die zusätzliche Bindung des Inhibitors an der allosterischen Stelle nicht umgesetzt. Die nicht-kompetitive Hemmung kann reversible oder irreversible sein. Ein Substratüberschuss verdrängt den Inhibitor nicht. Wenn der betrachtete Enzym-Substrat-Komplex jetzt unkompetitiv von einem Inhibitor gehemmt wird, sinken sowohl der Km-Wert als auch der Vmax – Wert. Das passiert, weil nach der Bindung des Inhibitors keine Produktbildung mehr stattfindet.
Was heißt das Wort kompetitiv : Bedeutungen: [1] mit jemandem im Wettbewerb stehend. Besonders, betont: in der Lage und bereit zu einem Kräftevergleich/Wettbewerb. [2] Chemie: miteinander konkurrierend, um eine chemische Verbindung einzugehen.
Was passiert bei der allosterischen Hemmung : Bei der allosterischen Hemmung bindet ein Inhibitor an das allosterische Zentrum des Enzyms. Durch diese Bindung wird die Raumstruktur des Enzyms verändert, weshalb das Substrat nicht am aktiven Zentrum des Enzyms binden kann. Die allosterische Hemmung ist reversibel.
Warum ist die Affinität größer Wenn der Km-Wert kleiner ist
Sie ist ein Maß für die Affinität eines Enzyms zu seinem Substrat, d.h. je kleiner Km ist, desto höher ist die Enzym-Substrat-Affinität, denn desto weniger Substrat ist nötig um die Hälfte alles Bindungsstellen der Enzyme zu besetzen (Enzym-Substrat-Affinität: Tendenz einen Enzym-Substrat-Komplex zu bilden). Kooperation (lateinisch cooperatio ‚Zusammenwirkung', ‚Mitwirkung') ist das zweckgerichtete Zusammenwirken, bzw. Zusammenarbeiten zweier oder mehrerer Lebewesen, Personen oder Systeme mit gemeinsamen Zielen oder Perspektiven.Bei der Endprodukthemmung wirkt das Endprodukt der Stoffwechselkette als allosterischer Inhibitor des ersten Enzyms der Stoffwechselkette. Je höher die Konzentration des Endproduktes bzw. Inhibitors ist, desto größer ist auch der Anteil der inaktiven Enzymmoleküle, und desto niedriger wird die Enzymaktivität.
Was ist der Km Wert einfach erklärt : Der KM-Wert beschreibt die Affinität des Enzyms zum Substrat – je niedriger der KM eines Enzyms für ein Substrat ist, desto spezifischer erfolgt die Reaktion d.h. es genügen bereits niedrige Substratkonzentrationen, um das Enzym mit halbmaximaler Geschwindigkeit arbeiten zu lassen.
Antwort Was versteht man unter einer kompetitiven Hemmung? Weitere Antworten – Was ist eine kompetitive Hemmung einfach erklärt
Kompetitive Hemmung einfach erklärt
Die kompetitive Hemmung ist eine Art der Enzymhemmung . Hier bindet ein Inhibitor (Hemmstoff) an das aktive Zentrum eines Enzyms . Auf diese Weise wird das Enzym gehemmt, weil das Substrat dann nicht mehr an das aktive Zentrum binden kann.Kompetitive und nicht-kompetitive Hemmung
Bindungsstelle des Inhibitors: Bei der kompetitiven Hemmung bindet der Inhibitor an das aktive Zentrum des Enzyms, bei der nicht-kompetitiven Hemmung bindet der Inhibitor hingegen an das allosterische Zentrum des Enzyms.Als allosterische Hemmung bezeichnet man eine Enzymhemmung, bei welcher die Bindung des Inhibitors nicht am aktiven Zentrum, sondern am allosterischen Zentrum erfolgt. Dabei wird die Konformation des Enzyms so moduliert, dass das Substrat nur erschwert oder gar nicht an das aktive Zentrum binden kann.

Welche Arten von Hemmungen gibt es : Inhaltsverzeichnis
Was passiert bei der nicht kompetitiven Hemmung
Wenn der Inhibitor am Enzym angedockt ist, verändert sich die Form des aktiven Zentrums. Das führt dazu, dass das Substrat nur noch erschwert oder gar nicht mehr an das Enzym binden kann. Der Inhibitor kann sich wieder vom Enzym lösen. Deshalb ist die nicht kompetitive Hemmung reversibel.
Ist eine kompetitive Hemmung immer reversibel : Kompetitive Hemmung
Der Inhibitor bindet am aktiven Zentrum und blockiert so die Interaktion des Substrats mit der Bindungsstelle. Der Inhibitor kann durch einen Überschuss des Substrats verdrängt werden; daher ist diese Hemmung reversible.
Als kompetitive Hemmung (lat. competere, zusammen etwas begehren) wird in der Biochemie und Pharmakologie eine Enzymhemmung bezeichnet, bei der ein Agonist und ein Antagonist um die Besetzung eines Rezeptors konkurrieren, wobei der Antagonist keine biochemische Wirkung hat.

Endprodukthemmung, ein wichtiger Mechanismus zur schnellen Regulation des Stoffwechsels durch reversible Enzymhemmung. Ein am Ende einer Stoffwechselsequenz gebildetes Produkt wirkt als negativer Effektor (Inhibitor) auf ein am Anfang der Reaktionsfolge lokalisiertes, meist allosterisches Enzym.
Ist allosterische Hemmung und nicht kompetitive Hemmung das gleiche
Ist eine allosterische Hemmung reversibel Die allosterische Hemmung ist reversibel und damit umkehrbar. Sie ist auch eine Sonderform der nicht kompetitiven Hemmung, da der Inhibitor nicht mit dem Substrat in Konkurrenz steht.Die allosterische Hemmung ist einer nicht kompetitiven Hemmung, weil der Inhibitor nicht mit dem Substrat um eine Bindestelle konkurriert. Beide binden an verschiedenen Zentren. Außerdem ist die allosterische Hemmung reversibel, also wieder umkehrbar.Nicht-kompetitive Hemmung
Das Substrat kann somit weiterhin an das aktive Zentrum binden, wird aber durch die zusätzliche Bindung des Inhibitors an der allosterischen Stelle nicht umgesetzt. Die nicht-kompetitive Hemmung kann reversible oder irreversible sein. Ein Substratüberschuss verdrängt den Inhibitor nicht.
Wenn der betrachtete Enzym-Substrat-Komplex jetzt unkompetitiv von einem Inhibitor gehemmt wird, sinken sowohl der Km-Wert als auch der Vmax – Wert. Das passiert, weil nach der Bindung des Inhibitors keine Produktbildung mehr stattfindet.
Was heißt das Wort kompetitiv : Bedeutungen: [1] mit jemandem im Wettbewerb stehend. Besonders, betont: in der Lage und bereit zu einem Kräftevergleich/Wettbewerb. [2] Chemie: miteinander konkurrierend, um eine chemische Verbindung einzugehen.
Was passiert bei der allosterischen Hemmung : Bei der allosterischen Hemmung bindet ein Inhibitor an das allosterische Zentrum des Enzyms. Durch diese Bindung wird die Raumstruktur des Enzyms verändert, weshalb das Substrat nicht am aktiven Zentrum des Enzyms binden kann. Die allosterische Hemmung ist reversibel.
Warum ist die Affinität größer Wenn der Km-Wert kleiner ist
Sie ist ein Maß für die Affinität eines Enzyms zu seinem Substrat, d.h. je kleiner Km ist, desto höher ist die Enzym-Substrat-Affinität, denn desto weniger Substrat ist nötig um die Hälfte alles Bindungsstellen der Enzyme zu besetzen (Enzym-Substrat-Affinität: Tendenz einen Enzym-Substrat-Komplex zu bilden).

Kooperation (lateinisch cooperatio ‚Zusammenwirkung', ‚Mitwirkung') ist das zweckgerichtete Zusammenwirken, bzw. Zusammenarbeiten zweier oder mehrerer Lebewesen, Personen oder Systeme mit gemeinsamen Zielen oder Perspektiven.Bei der Endprodukthemmung wirkt das Endprodukt der Stoffwechselkette als allosterischer Inhibitor des ersten Enzyms der Stoffwechselkette. Je höher die Konzentration des Endproduktes bzw. Inhibitors ist, desto größer ist auch der Anteil der inaktiven Enzymmoleküle, und desto niedriger wird die Enzymaktivität.
Was ist der Km Wert einfach erklärt : Der KM-Wert beschreibt die Affinität des Enzyms zum Substrat – je niedriger der KM eines Enzyms für ein Substrat ist, desto spezifischer erfolgt die Reaktion d.h. es genügen bereits niedrige Substratkonzentrationen, um das Enzym mit halbmaximaler Geschwindigkeit arbeiten zu lassen.